INDIVIDUAL
ENVIAR A : ribada.emanuel@gmail.com
FECHA DE ENTREGA: 8-05-2020
FECHA DE EXÁMEN: MARTES 12 DE MAYO 11 HS
Regla del Octeto
La regla del octeto, también llamada ley de Lewis, dice que todos los átomos de los elementos del sistema periódico, tienden a completar sus últimos niveles de energía con una cantidad de 8 electrones (menos el hidrógeno).
Son los electrones más alejados del núcleo, los que tienden a completarse hasta ser un total de 8 electrones y, para ello, compartirán electrones con otro átomo si es necesario.
Los gases nobles son los únicos no reactivos (no reaccionan o comparten con nadie), porque ya tienen 8 electrones en su última capa.
Enlace Covalente
Los enlace covalentes están formados por átomos NO METALICOS.Los elementos de la derecha de la tabla periódica son los elementos NO metálicos (color amarillo). Solo estos pueden formar los enlaces covalentes.
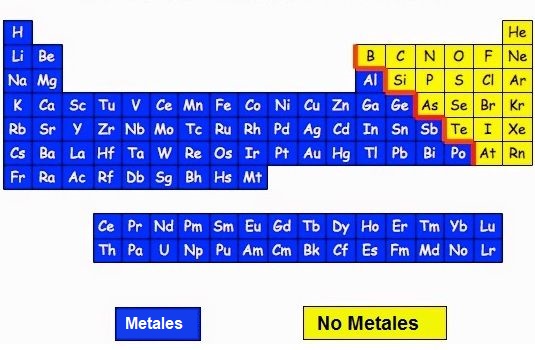
Los átomos No metálicos suelen tener muchos electrones girando en su último orbital por lo que tienden a ganar electrones de otro átomo en lugar de cederlos para tener los 8 electrones de la regla del octeto y tener la estabilidad de los gases nobles. El problema es que como los dos átomos están en este caso, los dos son no metales, ninguno de los dos querrá ceder sus electrones al otro.
Los no metales, como no quieren desprenderse de electrones, al encontrarse o unirse, lo que harán será compartir electrones externos, en lugar de ceder o ganar electrones.
Conclusión: los átomos no metálicos no pueden ceder ni ganar electrones entre si, si no que los comparten.
"Los enlaces covalentes se forman entre dos No Metales y compartiendo electrones.
Cuando se unen dos átomos no metálicos, los electrones que comparten los mantienen unidos y forman parte de los dos átomos, formando así una molécula (varios átomos unidos).
Pueden estar unidos por enlaces simples, dobles o triples, dependiendo de los electrones que compartan en la unión.
Formación de los Enlaces Covalentes
Veamos un ejemplo de formación de enlaces covalentes.
El Cloro es un NO metal. El cloro en estado natural se presenta en Cl2, es decir una molécula de cloro de 2 átomos. Los dos átomos de cloro están unidos mediante un enlace covalente.
El cloro tiene 7 electrones en su última capa, por lo tanto si comparten uno de estos electrones cada uno , en la molécula ya tendrían 8 electrones cada uno.
Perfecto han formado una molécula con dos átomos muy estables. Este enlace solo necesita compartir un electrón cada uno para formar el octeto.
Aquí lo puedes ver:

Otro caso es el de la molécula de oxígeno O2. Cada átomo de oxígeno tiene 6 electrones de valencia, con lo que tendrán que compartir 2 electrones cada uno para llegar al octeto.
Los enlaces covalentes pueden compartir 1, 2 o 3 electrones de valencia. Se llaman enlaces simples, dobles o triples. Aquí tienes un ejemplo de cada uno de ellos: Cl2, O2 y N2.
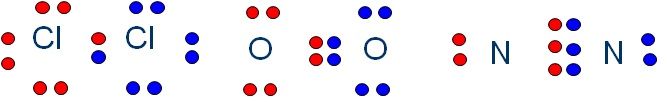
Normalmente estos enlaces de forma escrita se expresan poniendo un redondelito por cada electrón de valencia de cada átomo y una rayita por cada uno de los electrones compartidos en el enlace(fórmula semidesarrollada). Mira estos dos ejemplos:
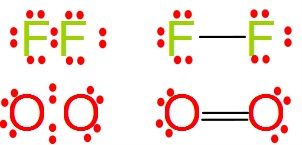
El F2 comparten 1 electrón, pues una rayita, el O2 comparten 2 electrones, pues 2 rayitas. El primero es simple y el segundo doble.